Подготовка к егэ по химии. алкены. Готовимся к егэ Тест алкены подготовка к егэ
Готовимся к ЕГЭ.Алканы.
АЛКАНЫ (предельные углеводороды, парафины)
Алканы – алифатические (ациклические) предельные углеводороды, в которых атомы углерода связаны между собой простыми (одинарными) связями в неразветвленные или разветвленные цепи, с общей формулой C n H 2n+2, где n ≥1.
Алканы
– название предельных углеводородов по международной номенклатуре.
Парафины
– исторически сложившееся название, отражающее свойства этих соединений (от лат.
parrum affinis
– имеющий мало сродства, малоактивный).
Предельными
, или
насыщенными
, эти углеводороды называют в связи с полным насыщением углеродной цепи атомами водорода.
Гомологический ряд алканов
Алканы, имея общую формулу С n H 2n+2 , представляют собой ряд родственных соединений с однотипной структурой, в котором каждый последующий член отличается от предыдущего на постоянную группу атомов (-CH 2 -). Такая последовательность соединений называется гомологическим рядом (от греч. homolog – сходный), отдельные члены этого ряда – гомологами , а группа атомов, на которую различаются соседние гомологи, – гомологической разностью .
- CH 4 – первый член гомологического ряда – метан (содержит 1 атом C);
- CH 3 -CH 3 или СН 3 -СН 3 – этан (2 атома С);
- CH 3 -CH 2 -CH 3 или СН 3 -СН 2 -СН 3 – пропан (3 атома С);
- CH 3 -CH 2 -CH 2 -CH 3 или СН 3 -СН 2 -СН 2 -СН 3 – бутан (4 атома С).
Суффикс -ан является характерным для названия всех алканов. Начиная с пятого гомолога, название алкана образуется из греческого числительного, указывающего число атомов углерода в молекуле, и суффикса -ан : пентан С 5 Н 12 , гексан С 6 Н 14 , гептан С 7 Н 16 , октан С 8 Н 18 , нонан С 9 Н 20 , декан С 10 Н 22 и т.д.
Гомологи отличаются молекулярной массой, и следовательно, физическими свойствами. С увеличением числа углеродных атомов в молекуле алкана в гомологическом ряду наблюдается закономерное изменение физических свойств гомологов: повышаются температуры кипения и плавления, увеличивается плотность. Все алканы легче воды, в ней не растворимы, однако растворимы в неполярных растворителях (например, в бензоле) и сами являются хорошими растворителями. Алканы от СН 4 до С 4 Н 10 – газы, от С 5 Н 12 до С 17 Н 36 – жидкости, далее – твердые вещества. Имея одинаковый качественный состав и однотипные химические связи, гомологи обладают сходными химическими свойствами. Поэтому, зная химические свойства одного из членов гомологического ряда, можно предсказать химическое поведение и других членов этого ряда.
Строение алканов
В алканах имеются два типа химических связей:
С–С и С–Н .
Связь С–С является ковалентной неполярной. Связь С–Н - ковалентная слабополярная, т.к. углерод и водород близки по электроотрицательности).
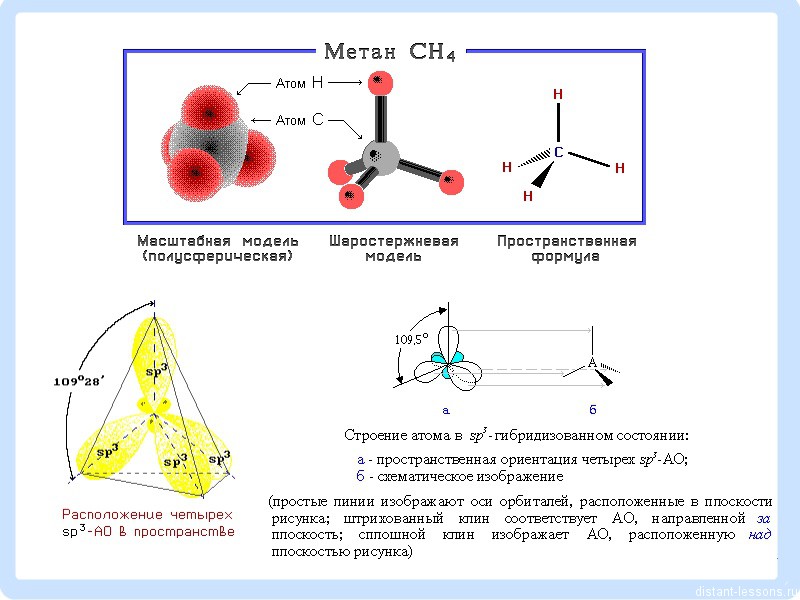
Все атомы углерода в алканах находятся в состоянии sp 3 -гибридизации.
Четыре σ-связи углерода направлены в пространстве под углом 109 о 28", что соответствует наименьшему отталкиванию электронов. Поэтому молекула простейшего представителя алканов – метана СН 4 – имеет форму тетраэдра, в центре которого находится атом углерода, а в вершинах – атомы водорода.
Изомерия алканов
Изомерия – явление существования соединений, которые имеют одинаковый состав (одинаковую молекулярную формулу), но разное строение. Такие соединения называются изомерами .
Различия в порядке соединения атомов в молекулах (т.е. в химическом строении) приводят к структурной изомерии (изомерии углеродного скелета) . В ряду алканов структурная изомерия проявляется при содержании в цепи 4-х и более атомов углерода, т.е. начиная с бутана С 4 Н 10 . Например, алкан состава C 4 H 10 может существовать в виде двух структурных изомеров:
СН 3 –СН 2 –СН 2 –СН 3 (бутан) и СН 3 –СН(СН 3 )–СН 3 (2-метилпропан).
Структурные изомеры отличаются физическими свойствами. Алканы с разветвленным строением из-за менее плотной упаковки молекул и, соответственно, меньших межмолекулярных взаимодействий, кипят при более низкой температуре, чем их неразветвленные изомеры.
Химические свойства алканов
Тривиальное (историческое) название алканов - "парафины" - означает "не имеющие сродства". Алканы при нормальных условиях химически малоактивны. Низкая реакционная способность алканов обусловлена очень малой полярностью связей С-С и С-Н в их молекулах вследствие почти одинаковой электроотрицательности атомов углерода и водорода. Предельные углеводороды в обычных условиях не взаимодействуют ни с концентрированными кислотами, ни со щелочами, ни даже с таким активным реагентом как перманганат калия. К реакциям присоединения алканы вообще не способны в силу предельной насыщенности всех связей атомов углерода.
I. Реакции замещения
В определенных условиях (при нагревании, или на свету, или с применением катализаторов) происходит разрыв С-Н-связей и осуществляется замена атомов водорода на другие атомы или группы атомов. В этих реакциях происходит гомолитическое расщепление кoвалентных связей, т. е. они осуществляются по свободно-радикальному (цепному) механизму.
1) Галогенирование
Галогенирование алканов – реакция замещения одного или более атомов водорода в молекуле алкана на галоген. Продукты реакции называют галогеналканами или галогенопроизводными алканов R-Cl или С n H 2n+1 – Cl.
Реакция алканов с хлором и бромом идет на свету или при нагревании.
Хлорирование метана :
CH 4 + Cl 2 hν → CH 3 Cl + HCl (1 стадия)
(hν - квант света; CH 3 Cl - хлорметан)
При достаточном количестве хлора реакция продолжается дальше:
CH 3 Cl + Cl 2 hν → CH 2 Cl 2 + HCl (2 стадия)
(CH 2 Cl 2 – дихлорметан)
СH 2 Cl 2 + Cl 2 hν → CHCl 3 + HCl (3 стадия)
(CHCl 3 – трихлорметан или хлороформ)
CHCl 3 + Cl 2 hν → CCl 4 + HCl (4 стадия)
(CCl 4 – тетрахлорметан)
Реакция галогенирования алканов протекает по радикальному цепному механизму. В разработке теории цепных реакций большую роль сыграли труды академика, лауреата Нобелевской премии Н.Н.Семенова.
Скорость реакции замещения водорода на атом галогена у галогеналканов выше, чем у соответствующего алкана, это связано с взаимным влиянием атомов в молекуле. При увеличении углеводородного радикала наиболее подвижными остаются атомы водорода у атома углерода ближайщего к заместителю:
CH 3 –CH 2 –Cl + Cl 2 hν → CH 3 – CHCl 2 + HCl
(CH 3 – CHCl 2 – 1,1-дихлорэтан)
При хлорировании или бромировании алкана с вторичными или третичными атомами углерода легче всего идет замещение водорода у третичного атома, труднее у вторичного и еще труднее у первичного. Это объясняется большей устойчивостью третичных и вторичных углеводородных радикалов по сравнению с первичными вследствие делокализации неспаренного электрона. Поэтому, например, при бромировании пропана основным продуктом реакции является 2-бромпропан:
С фтором реакция идёт со взрывом .
2) Нитрование (реакция Коновалова)
Несмотря на то, что в обычных условиях алканы не взаимодействуют с концентрированной азотной кислотой, при нагревании до 140°С с разбавленной (10%-ной) азотной кислотой под давлением осуществляется реакция нитрования – замещение атома водорода нитрогруппой NO 2 . Пpодукты pеакции – нитpоалканы R-NO 2 или С n H 2n+1 – NO 2 .
Схема реакции:
CH 4 + HNO 3 t˚С,Р → CH 3 NO 2 + H 2 O (при нитровании метана получается нитрометан).
В реакциях легче всего замещаются атомы водорода у третичных атомов углерода, затем у вторичных и, в последнюю очередь, у первичных.
3) Сульфирование
Серная кислота при обыкновенной температуре не действует на алканы, а при слабом нагревании концентрированная серная кислота может действовать на предельные углеводороды приводя к замещению атома водорода на сульфогруппу SO 3 H
II. Реакции окисления алканов
При обычной температуре алканы не вступают в реакции даже с сильными окислителями (Н 2 Cr 2 O 7 , KMnO 4 и т.п.).
1) При внесении в открытое пламя алканы горят. При этом в избытке кислорода происходит их полное окисление до СО 2 и воды. Горение углеводородов сопровождается выделением большого количества тепла (экзотермическая реакция).
CH 4 + 2O 2 →CO 2 + 2H 2 O+ Q
C
5
H
12
+ 8O
2
→5CO
2
+ 6H
2
O + Q
Уравнение реакции горения алканов в общем виде:
Из этого уравнения следует, что с увеличением числа углеродных атомов (n
) в алкане увеличивается количество кислорода, необходимого для его полного окисления. При горении высших алканов (n
>>1) кислорода, содержащегося в воздухе, может оказаться недостаточно для их полного окисления до СО
2
. Тогда образуются продукты частичного окисления:
угарный газ
СО,
сажа
(мелкодисперсный углерод, нулевая степень окисления). Поэтому высшие алканы горят на воздухе коптящим пламенем, а выделяющийся попутно токсичный угарный газ (без запаха и цвета) представляет опасность для человека.
Горение метана при недостатке кислорода происходит по уравнениям:
2CH 4 + 3O 2 →2CO +4H 2 O
CH 4 + O 2 →C +2H 2 O
2) Каталитическое окисление кислородом воздуха.
Частичное окисление алканов при относительно невысокой температуре и с применением катализаторов сопровождается разрывом только части связей С-С и С-Н и используется для получения ценных продуктов: карбоновых кислот, кетонов, альдегидов, спиртов.
2CH 4 + O 2 →2CH 3 OH (CH 3 OH - метанол)
CH 4 + O 2 →HCOH +H 2 O (HCOH - метаналь)
2CH 4 + 3O 2 →2HCOOH +2H 2 O (HCOOH – метановая кислота)
При неполном окислении бутана получают уксусную кислоту:
2C 4 H 10 + 5O 2 →4СH 3 COOH +2H 2 O
III.Термические превращения алканов
1) Крекинг алканов – процесс термического разложения углеводородов, в основе которого лежат реакции расщепления углеродной цепи крупных молекул с образованием молекул алканов и алкенов с более короткой цепью.
Крекинг алканов является основой переработки нефти с целью получения продуктов меньшей молекулярной массы, которые используются в качестве моторных топлив, смазочных масел и т.п., а также сырья для химической и нефтехимической промышленности.
Для осуществления этого процесса используются два способа:
термический крекинг
(при нагревании без доступа воздуха) и
каталитический крекинг
(более умеренное нагревание в присутствии катализатора).
C 10 H 22 t°С → C 5 H 12 + C 5 H 10
2) Дегидрирование алканов
При нагревании алканов в присутствии катализаторов (Pt, Pd, Ni, Cr 2 O 3 , Al 2 O 3 ) происходит их каталитическое дегидрирование – отщепления атомов водорода за счет разрыва связей С-Н.
3)Изомеризация алканов.
Алканы нормального строения под влиянием катализаторов и при нагревании способны превращаться в разветвленные алканы без изменения состава молекул, т.е. вступать в реакции изомеpизации. В этих pеакциях участвуют алканы, молекулы которых содержат не менее 4-х углеродных атомов.
Например, изомеризация н-пентана в изопентан (2-метилбутан) происходит при 100°С в присутствии катализатора хлорида алюминия:
4) Реакция дегидроциклизации или ароматизации
Алканы с основной цепью в 6 и более атомов углерода вступают в реакцию дегидроциклизации, но всегда образуют 6-членный цикл (циклогексан и его производные). В условиях реакции этот цикл подвергается дальнейшему дегидрированию и превращается в энергетически более устойчивый бензольный цикл ароматического углеводорода (арена). Например:
Эти реакции лежат в основе процесса риформинга – переработки нефтепродуктов с целью получения аренов (ароматизация предельных углеводородов) и водорода. Превращение н-алканов в арены ведет к улучшению детонационной стойкости бензина.
5)Термическое разложение до простых веществ
CH 4 t → C + 2H 2
6) Пиролиз метана.
При 1500 °С происходит межмолекулярное дегидрирование метана
с образованием ацетилена:
2CH 4 1500°С → C 2 H 2 + 3H 2
Данная реакция используется для промышленного получения ацетилена.
IV.Конверсия метана
Важное значение имеет реакция взаимодействия метана с водяным паром, в результате которой образуется смесь оксида углерода (II) с водородом - "синтез-газ":
Эта реакция используется для получения водорода. Синтез-газ служит сырьем для получения различных углеводородов.
Получение алканов
Алканы выделяют из природных источников (природный и попутный газы, нефть). Природный газ до 95 % состоит из метана. Такой же состав имеет болотный газ, образующийся в результате переработки бактериями (гниения) углеводов. Попутные нефтяные газы состоят в основном из этана, пропана, бутана и частично пентана. Их отделяют от нефти на специальных установках по подготовке нефти. При отсутствии газоконденсатных станций попутные нефтяные газы сжигают в факелах, что является крайне неразумной и разорительной практикой в нефтедобыче. Одновременно с газами нефть очищается от воды, грязи и песка, после чего поступает в трубу для транспортировки. Из нефти при ее перегонке получают
более 100 индивидуальных соединений, нормальных и разветвленных алканов, циклоалканов и ароматических углеводородов.
Используются также синтетические методы.
- Крекинг алканов (промышленный способ)
- Гидpиpование непpедельных углеводоpодов:
C n H 2n + H 2 t˚С, Ni или Pd → C n H 2n+2
Синтез более сложных алканов при действии металлического натрия на моногалогеналканы с меньшим числом атомов углеpода:
2CH3–CH2Br+2Na→CH3–CH2–CH2–CH3+2NaBr
Реакция Вюрца имеет смысл лишь для получения из одного алкилгалогенида, поскольку в противном случае получается трудноразделимая в лабораторных условиях смесь алканов.
Например:
Кроме пропана C 3 H 8 образуются бутан C 4 H 10 (из 2-х молекул C 2 H 5 Br) и этан C 2 H 6 (из 2-х молекул CH 3 Br).
- Термическое декарбоксилирование. Сплавление солей карбоновых кислот со щелочью (реакция Дюма):
или в общем виде
R-COONa + NaOH
R-H + Na
2
CO
3
- Электролиз солей карбоновых кислот (реакция Кольбе):
- Изомеризация. Под влиянием катализаторов при нагревании алканы нормального строения подвергаются изомеризации - перестройке углеродного скелета с образованием алканов разветвленного строения
- Жидкие углеводоpоды составляют значительную долю в моторных и ракетных топливах и используются в качестве растворителей.
- Вазелиновое масло (смесь жидких углеводоpодов с числом атомов углерода до 15) - пpозpачная жидкость без запаха и вкуса, используется в медицине, паpфюмеpии и косметике.
- Вазелин (смесь жидких и твеpдых пpедельных углеводоpодов с числом углеpодных атомов до 25) пpименяется для пpиготовления мазей, используемых в медицине.
- Паpафин (смесь твеpдых алканов С 19 -С 35 ) - белая твеpдая масса без запаха и вкуса (т.пл. 50-70 °C) - пpименяется для изготовления свечей, пpопитки спичек и упаковочной бумаги, для тепловых пpоцедуp в медицине. Служит сырьём при получении органических кислот и спиртов, моющих средств и поверхностно-активных веществ.
- Нормальные предельные углеводороды средней молекулярной массы используются как питательный субстрат в микробиологическом синтезе белка из нефти.
- Большое значение имеют галогенопроизводные алканов, которые используются как растворители, хладоагенты и сырье для дальнейших синтезов.
- В современной нефтехимической промышленности предельные улеводороды являются базой для получения разнообразных органических соединений, важным сырьем в процессах получения полупродуктов для производства пластмасс, каучуков, синтетических волокон, моющих средств и многих других веществ.
Источники
- Г.И.Дерябина, Г.В.Кантария. Органическая химия. Электронный ресурс .
- И.И.Новошинский, Н.С.Новошинская. Органическая химия: пособие для старшеклассников и абитуриентов. – М.:ООО «Издательский дом ОНИКС 21 век»,2004
- Кузьменко Н.Е.,Еремин В.В., Попков В.А. Начала химии. Современный курс для поступающих в вузы. М.: Экзамен, 2002.
– это предельные (или насыщенные) нециклические углеводороды, в которых все связи одинарные.
Общая формула:
C n H 2 n +2
Все атомы углерода в алканах имеют sp 3 - гибридизацию.
Первые четыре члена гомологического ряда алканов – газы, C 5 –C 17 – жидкости, начиная с C 18 – твердые вещества. Все алканы легче воды, не растворимы в воде и не смешиваются с ней.
Химические свойства.
1) Связь углерода с водородом в алканах малополярна.
2) Поэтому разрыв её в реакциях возможен только по гомолитическому механизму:
Это возможно только в жестких условиях.
3) Насыщенные (предельные) углеводороды не имеют возможности вступать в реакции присоединения. Для них свойственны реакции замещения водородных атомов и расщепления. Эти реакции протекают или при нагревании, или на свету, или с применением катализаторов.
Алканы не реагируют с концентрированными кислотами, щелочами, перманганатом калия, бромной водой.
I. Реакции замещения.
1) Галогенирование: радикальное замещение.
Хлор и бром на свету или при нагревании.
А) хлорирование: процесс быстрый, поэтому протекает неизбирательно, образуется смесь продуктов замещения:
СН 3 - СН 2 - СН 3 + Cl 2 – ( свет ) CH 3 -CH 2 -CH 2 Cl + CH 3 -CHCl-CH 3 + HCl
Б) бромирование:
CH 3 CH 3
СН 3 -СН 2 -СН -СН 3 +Br 2 –(свет) СН 3 -СН 2 -С -СН 3 + HBr
Бромирование – более медленный и избирательный процесс.
Избирательность бромирования:
третичный > вторичный > первичный атом углерода.
Механизм радикального замещения: Цепной свободнорадикальный.
Свободный радикал R ∙ – это ОЧЕНЬ АКТИВНАЯ частица, несущая на себе один неспаренный электрон и стремящаяся образовать связь с каким-либо другим атомом.
1) Инициирование цепи (запуск): молекула хлора под действием кванта света разрывается на два радикала Cl · :
2) Развитие цепи: радикал хлора отрывает от алкана атом водорода. При этом образуется промежуточная частица - алкильный радикал, который в свою очередь отрывает атом хлора от молекулы Cl 2 . При этом вновь получается радикал хлора и процесс повторяется – идёт продолжение цепи:
3) Обрыв цепи: соединение двух радикалов в молекулу.
2) Нитрование
(реакция М.И. Коновалова):
Механизм реакции – также радикальный.
Нагревание до 140°С с разбавленной (10%-ной) азотной кислотой:
CH 3 CH 3
СН 3 -СН 2 -СН-СН 3 + HNO 3 СН 3 -СН 2 -С-СН 3 + H 2 O
Избирательность нитрования: NO 2
третичный > вторичный > первичный атом углерода.
3) Крекинг - превращения алканов под действием нагревания.
а) Для алканов с длинными цепями при крекинге получается алкан и алкен. Причём при длине больше 5 атомов С получится смесь углеводородов разной длины.
CH 3 –CH 2 –CH 2 –CH 3 - 400°C CH 3 -CH 3 + CH 2 =CH 2
б) Крекинг метана происходит двумя возможными путями:
1. длительное нагревание метана: CH 4 - 1500° C C + 2H 2
2. мгновенное нагревание до 1500 градусов и сразу охлаждение:
2CH 4 - 1500° C H –C ≡ C –H + 3H 2
Ацетилен
4) Изомеризация – перестройка углеродного скелета с образованием других изомеров: при нагревании с катализатором AlCl 3 .
СН 3 -СН 2 -СН 2 -СН 3 -(100 о, AlCl 3) CH 3 -CH -CH 3
5) Окисление:
1) Горение:
CH 4 + 2O 2 ⇆
CO 2 + 2H 2 O
C 5 H 12 + 8O 2 ⇆
5CO 2 + 6H 2 O
2) Каталитическое окисление:
Метана: СН 4 +О 2 - (катализатор) смесь СН 3 ОН, НСОН и НСООН
Бутана: С 4 Н 10 + О 2 - (катализатор) 2 СН 3 СООН (уксусная кислота)
6) Дегидрирование и циклизация.
1) Короткие алканы дегидрируются в алкены или диены:
С 2 Н 6 –(кат., t ) C 2 H 4 + H 2
CH 3 -CH 2 -CH 2 -CH 3 –(кат.Cr 2 O 3 , t ) бутадиен + Н 2
2) В присутствии катализатора гексан и гептан превращаются в бензол и толуол соответственно.
СН 3 -СН 2 -СН 2 -СН 2 -СН 2 -СН 3 –(кат.Pt , t ) + 4 Н 2
Получение:
1) Реакция Вюрца: действие металлического натрия на моногалогенопроизводные углеводородов:
2CH 3 –CH 2 Br + 2Na CH 3 –CH 2 –CH 2 –CH 3 +2NaBr
Происходит удвоение углеродного скелета. Реакция подходит для получения симметричных алканов.
2) Декарбоксилирование солей карбоновых кислот (реакция Дюма): сплавление солей карбоновых кислот со щелочами.
Так получают метан при нагревании ацетата натрия с гидроксидом натрия.
CH 3 COONa + NaOH( сплавление ) CH 4 + Na 2 CO 3
3) Электролиз растворов солей карбоновых кислот (реакция Кольбе):
2CH 3 COONa + 2H 2 O –(эл.ток) 2СО 2 + Н 2 + С 2 Н 6 + 2NaOH
катод:
идёт разрядка воды: 2Н 2 О + 2е Н 2 + 2ОН -
анод:
разрядка аниона кислоты: 2СН 3 СОО - -2е 2СО 2 + СН 3 -СН 3
4) Гидролиз карбида алюминия – получение метана.
Al 4 C 3 + 12H 2 O 3CH 4 + 4Al(OH) 3
5) Гидрирование непредельных или циклических углеводородов в присутствии катализаторов (платины, палладия, никеля).
R–CH=CH–R’ + H 2 – kat R–CH 2 –CH 2 –R’
(циклопропан) + H 2 – Pd CH 3 –CH 2 –CH 3 (пропан)
6) Алканы можно получить из нефти крекингом или фракционной перегонкой.
Строение алканов
Алканы - углеводороды, в молекулах которых атомы связаны одинарными связями и которые соответствуют общей формуле C n H 2n+2 . В молекулах алканов все атомы углерода находятся в состоянии sр 3 -гибридизации .
Это означает, что все четыре гибридные орбитали атома углерода одинаковы по форме, энергии и направлены в углы равносторонней треугольной пирамиды - тетраэдра . Углы между орбиталями равны 109° 28′. Вокруг одинарной углерод-углеродной связи возможно практически свободное вращение, и молекулы алканов могут приобретать самую разнообразную форму с углами при атомах углерода, близкими к тетраэдрическому (109° 28′), например, в молекуле н-пентан.

Особо стоит напомнить о связях в молекулах алканов. Все связи в молекулах предельных углеводородов одинарные. Перекрывание происходит по оси, соединяющей ядра атомов, т. е. это σ-связи . Связи углерод - углерод являются неполярными и плохо поляризуемыми. Длина С-С связи в алканах равна 0,154 нм (1,54 10 10 м). Связи С-Н несколько короче. Электронная плотность немного смещена в сторону более электроотрицательного атома углерода, т. е. связь С-Н является слабополярной .
Гомологический ряд метана
Гомологи - вещества, сходные по строению и свойствам и отличающиеся на одну или более групп СН 2 .


Предельные углеводороды составляют гомологический ряд метана.
Изомерия и номенклатура алканов
Для алканов характерна так называемая структурная изомерия . Структурные изомеры отличаются друг от друга строением углеродного скелета. Простейший алкан, для которого характерны структурные изомеры, - это бутан.

Рассмотрим подробнее для алканов основы номенклатуры ИЮПАК .
1. Выбор главной цепи . Формирование названия углеводорода начинается с определения главной цепи - самой длинной цепочки атомов углерода в молекуле, которая является как бы ее основой.
2. Нумерация атомов главной цепи . Атомам главной цепи присваивают номера. Нумерация атомов главной цепи начинается с того конца, к которому ближе стоит заместитель (структуры А, Б). Если заместители находятся на равном удалении от конца цепи, то нумерация начинается от того конца, при котором их больше (структура В). Если различные заместители находятся на равном удалении от концов цепи, то нумерация начинается с того конца, к которому ближе старший (структура Г). Старшинство углеводородных заместителей определяется по тому, в каком порядке следует в алфавите буква, с которой начинается их название: метил (-СН 3), затем пропил (-СН 2 -СН 2 -СН 3), этил (-СН 2 -СН 3) и т. д.
Обратите внимание на то, что название заместителя формируется заменой суффикса -ан на суффикс -ил в названии соответствующего алкана.
3. Формирование названия . В начале названия указывают цифры - номера атомов углерода, при которых находятся заместители. Если при данном атоме находятся несколько заместителей, то соответствующий номер в названии повторяется дважды через запятую (2,2-). После номера через дефис указывают количество заместителей (ди - два, три - три, тетра - четыре, пента - пять) и название заместителя (метил, этил, пропил). Затем без пробелов и дефисов - название главной цепи. Главная цепь называется как углеводород - член гомологического ряда метана (метан, этан, пропан и т. д.).




Названия веществ, структурные формулы которых приведены выше, следующие:
Структура А: 2-метилпропан;
Структура Б: 3-этилгексан;
Структура В: 2,2,4-триметилпентан;
Структура Г: 2-метил 4-этилгексан.
Отсутствие в молекулах предельных углеводородов полярных связей приводит к тому, что они плохо растворяются в воде , не вступают во взаимодействие с заряженными частицами (ионами) . Наиболее характерными для алканов являются реакции, протекающие с участием свободных радикалов .
Физические свойства алканов
Первые четыре представителя гомологического ряда метана - газы . Простейший из них - метан - газ без цвета, вкуса и запаха (запах «газа», почувствовав который, надо звонить 04, определяется запахом меркаптанов - серосодержащих соединений, специально добавляемых к метану, используемому в бытовых и промышленных газовых приборах для того, чтобы люди, находящиеся рядом с ними, могли по запаху определить утечку).
Углеводороды состава от С 5 Н 12 до С 15 Н 32 - жидкости; более тяжелые углеводороды - твердые вещества. Температуры кипения и плавления алканов постепенно увеличиваются с возрастанием длины углеродной цепи. Все углеводороды плохо растворяются в воде, жидкие углеводороды являются распространенными органическими растворителями.


Химические свойства алканов
Реакции замещения.
Наиболее характерными для алканов являются реакции свободнорадикального замещения , в ходе которого атом водорода замещается на атом галогена или какую-либо группу.
Приведем уравнения характерных реакций галогенирования :
В случае избытка галогена хлорирование может пойти дальше, вплоть до полного замещения всех атомов водорода на хлор :

Полученные вещества широко используются как растворители и исходные вещества в органических синтезах.
Реакция дегидрирования (отщепления водорода).
В ходе пропускания алканов над катализатором (Pt, Ni, Al 2 O 3 , Cr 2 O 3) при высокой температуре (400-600 °C) происходит отщепление молекулы водорода и образование алкена :
Реакции, сопровождающиеся разрушением углеродной цепи. Все предельные углеводороды горят с образованием углекислого газа и воды. Газообразные углеводороды, смешанные с воздухом в определенных соотношениях, могут взрываться.
1. Горение предельных углеводородов - это свободнорадикальная экзотермическая реакция, которая имеет очень большое значение при использовании алканов в качестве топлива:
В общем виде реакцию горения алканов можно записать следующим образом:
2. Термическое расщепление углеводородов .
Процесс протекает по свободнорадикальному механизму . Повышение температуры приводит к гомолитическому разрыву углерод-углеродной связи и образованию свободных радикалов.
Эти радикалы взаимодействуют между собой, обмениваясь атомом водорода, с образованием молекулы алкана и молекулы алкена :
Реакции термического расщепления лежат в основе промышленного процесса - крекинга углеводородов . Этот процесс является важнейшей стадией переработки нефти.
3. Пиролиз . При нагревании метана до температуры 1000 °С начинается пиролиз метана - разложение на простые вещества:
При нагревании до температуры 1500 °С возможно образование ацетилена :
4. Изомеризация . При нагревании линейных углеводородов с катализатором изомеризации (хлоридом алюминия) происходит образование веществ с разветвленным углеродным скелетом :

5. Ароматизация . Алканы с шестью или более углеродными атомами в цепи в присутствии катализатора циклизуются с образованием бензола и его производных:

Алканы вступают в реакции, протекающие по свободнорадикальному механизму, т. к. все атомы углерода в молекулах алканов находятся в состоянии sp 3 -гибридизации. Молекулы этих веществ построены при помощи ковалентных неполярных С-С (углерод - углерод) связей и слабополярных С-Н (углерод - водород) связей. В них нет участков с повышенной и с пониженной электронной плотностью, легко поляризуемых связей, т. е. таких связей, электронная плотность в которых может смещаться под действием внешних факторов (электростатических полей ионов). Следовательно, алканы не будут реагировать с заряженными частицами, т. к. связи в молекулах алканов не разрываются по гетеролитическому механизму.
Алкены – это углеводороды, в молекулах которых есть ОДНА двойная С=С связь.
Общая формула алкенов:
C n H 2 n
Тип гибридизации атома углерода двойной связи – sp 2 . Остальные атомы углерода в молекуле алкена обладают sp 3 - гибридизацией.
Молекула имеет плоское строение, угол между σ-связями – 120 0
Длина двойной связи меньше, чем длина одинарной.
Номенклатура алкенов: в названии появляется суффикс -ЕН.
Первый член гомологического ряда – С 2 Н 4 (этен).
Для простейших алкенов применяются также исторически сложившиеся названия:
этилен (этен),
пропилен (пропен),
В номенклатуре часто используются следующие одновалентные радикалы алкенов:
СН 2 -СН=СН 2
Виды изомерии алкенов:
1. Изомерия углеродного скелета: (начиная с С 4 Н 8 – бутен и 2-метилпропен)
2. Изомерия положения кратной связи: (начиная с С 4 Н 8): бутен-1 и бутен-2.
3. Межклассовая изомерия: с циклоалканами (начиная с пропена):
C 4 H 8 - бутен и циклобутан.
4. Пространственная изомерия алкенов:
Из-за того, что вокруг двойной связи невозможно свободное вращение, становится возможной цис-транс- изомерия .
Алкены, имеющие у каждого из двух атомов углерода при двойной связи различные заместители , могут существовать в виде двух изомеров, отличающихся расположением заместителей относительно плоскости π-связи:
Химические свойства алкенов.
Для алкенов характерны:
реакции присоединения к двойной связи,
реакции окисления,
реакции замещения в «боковой цепи».
1. Реакции присоединения по двойной связи: менее прочная π-связь разрывается, образуется насыщенное соединение.
Это реакции электрофильного присоединения - А Е.
1) Гидрирование:
СН 3 -СН=СН 2 + Н 2 CH 3 -CH 2 -CH 3
2) Галогенирование:
СН 3 -СН=СН 2 + Br 2 (раствор) CH 3 -CHBr -CH 2 Br
Обесцвечивание бромной воды – качественная реакция на двойную связь.
3) Гидрогалогенирование:
СН 3 -СН=СН 2 + НBr CH 3 -CHBr -CH 3
(ПРАВИЛО МАРКОВНИКОВА: водород присоединяется к наиболее гидрированному атому углерода).
4) Гидратация - присоединение воды:
СН 3 -СН=СН 2 + НОН CH 3 -CH -CH 3
(присоединение также происходит по праилу Марковникова)
2. Присоединение бромоводорода в присутствии пероксидов (эффект Хараша) - это радикальное присоединение - А R
СН 3 -СН=СН 2 + HBr -(Н 2 О 2) СН 3 -СН 2 -СН 2 Br
(реакция с бромоводородом в присутствии пероксида протекает против правила Марковникова )
3. Горение – полное окисление алкенов кислородом до углекислого газа и воды.
С 2 Н 4 + 3О 2 = 2СО 2 + 2Н 2 О
4. Мягкое окисление алкенов – реакция Вагнера : реакция с холодным водным раствором перманганата калия.
3СН 3 -СН=СН 2 + 2KMnO 4 + 4H 2 O 2MnO 2 + 2KOH + 3СН 3 - СН - СН 2
ô ô
OH OH
(образуется диол)
Обесцвечивание алкенами водного раствора перманганата калия – качественная реакция на алкены.
5. Жесткое окисление алкенов – горячим нейтральным или кислым раствором перманганата калия. Идёт с разрывом двойной связи С=С.
1. При действии перманганата калия в кислой среде в зависимости от строения скелета алкена образуется:
Фрагмент углеродной цепи у двойной связи
Во что превращается
=С Н 2
С О 2
= СН – R
R – C OOH карбоновая кислота
= C – R
ô
R
кетон R – C – R
║
O
СН 3 -С -1 Н =С -2 Н 2 +2 KMn +7 O 4 + 3H 2 SO 4
CH 3 -C +3 OOH + C +4 O 2 + 2Mn +2 SO 4 + K 2 SO 4 + 4H 2 O
2. Если реакция протекает в нейтральной среде ПРИ нагревании, то соответственно получаются калиевые соли :
Фрагмент цепи у двойной связи
Во что превращается
=С Н 2
К 2 С О 3
= СН – R
R – C OO К - солькарбоновой кислоты
= C – R
ô
R
кетон R – C – R
║
O
3СН 3 С -1 Н =С -2 Н 2 +10K MnO 4 -t 3CH 3 C +3 OO K + + 3K 2 C +4 O 3 + 10MnO 2 +4Н 2 О+ K OH
6. Окисление кислородом этилена в присутствии солей палладия.
СН 2 =СН 2 + O 2 –(kat ) C Н 3 СНО
(уксусный альдегид)
7. Хлорирование и бромирование в боковую цепь: если реакция с хлором проводится на свету или при высокой температуре – идёт замещение водорода в боковой цепи.
СН 3 -СН=СН 2 + Cl 2 – (свет) СН 2 -СН=СН 2 +HCl
8. Полимеризация:
n СН 3 - СН= СН 2 (-CH–CH 2 -) n
пропилен полипропилен
CH 3
ПОЛУЧЕНИЕ АЛКЕНОВ
I. Крекинг алканов:
С 7 Н 16 –(t ) CH 3 - CH =CH 2 + C 4 H 10
Алкен алкан
II. Дегидрогалогенирование галогеналканов при действии спиртового раствора щелочи - реакция ЭЛИМИНИРОВАНИЯ.
Правило Зайцева: Отщепление атома водорода в реакциях элиминирования происходит преимущественно от наименее гидрогенизированного атома углерода.
III . Дегидратация спиртов при повышенной температуре (выше 140°C) в присутствии водоотнимающих реагентов - оксида алюминия или концентрированной серной кислоты – реакция элиминирования.
CH 3 -CH-CH 2 -CH 3 – (H 2 SO 4 ,t>140 o) H 2 O +CH 3 -CH=CH -CH 3
OH
(также подчиняется правилу Зайцева)
IV . Дегалогенирование дигалогеналканов , имеющих атомы галогена у соседних атомов углерода , при действии активных металлов.
CH 2 Br -CHBr -CH 3 +Mg CH 2 =CH-CH 3 +Mg Br 2
Также может использоваться цинк.
V . Дегидрирование алканов при 500°С:
VI . Неполное гидрирование диенов и алкинов
С 2 Н 2 + Н 2 (недостаток) –(kat ) С 2 Н 4
Органическая химия — это химия углерода, валентность которого равна 4. Т.е., каждый атом углерода образует 4 связи (сигма-связи). Это может быть связь — С — С — , это может быть связь -С-H. Одинарная связь считается насыщенной , т.е. достигается максимальное перекрывание электронной плотности между атомами.
Предельные углеводороды — класс алканы (углеводороды с насыщенными связями)
Сигма-связь (σ-)
Атомы углерода находятся в состоянии Sp³-гибридизации:
Т.е. вещества класса Алканы (парафины — старое название) - алифатические (нециклические) предельные углеводороды, в которых атомы углерода связаны между собой простыми (одинарными, насыщенными) связями в неразветвленные или разветвленные цепи. Угол между связями С-C составляет 109°28′, поэтому молекулы нормальных алканов с большим числом атомов углерода имеют зигзагообразное строение (зигзаг)
Общая формула алканов: С n H 2n+2 , где n = числу атомов углерода.
Номенклатура веществ класса алканов строится из двух частей.
Первая часть «говорит» о количестве атомов углерода, вторая — о связи -С-С-. У алканов вторая часть — всегда -ан , а первую часть надо выучить:
Физические свойства алканов:
C1-C4 — газообразные вещества;
С5- С17 — жидкости;
С18-… — твердые вещества.
Химические свойства
Алканы — довольно химически устойчивы. Между атомами насыщенная связь, поэтому вещества класса алканы очень слабо активны.
Максимум на что они способны это:
Реакции замещения: реакция идет на свету по радикальному механизму:
С2H6 + Cl2 = C2H5Cl + HCl, такое замещение может идти до полного замещения атомами хлора атомов водорода: С2Сl6.
Реакция Вюрца — «именная» реакция удлиннения цепи:
C2H5Cl + 2Na +ClC2H5 → C4H10 + 2NaCl (из этана получили бутан)
Реакция Коновалова: c разбавленной азотной кислотой под давлением
С2H6 + HNO3 (HO-NO2) → С2H5NO2 + H2O
Реакции разложения (крекинг):
длинные вещества класса алканы разлагается на алкан (более короткий) и алкен:
CH 3 -CH 2 -CH 3 (пропан) - 400°C > CH 4 (метан)+ CH 2 =CH 2 (этилен)
Окисление алканов (горение): как и все органические вещества, алканы горят до образования углекислого газа и воды:
2C2H6 + 7O2 = 4CO2 + 6H2O
Получение веществ класса алканы:
Из неорганических веществ:
гидролиз карбида алюминия:
Al4C3 + 12H2O = 4Al(OH)3 +3CH4 (метан)
C+2H2 = CH4 (при высоком давлении и температуре)
Гидрирование алкенов:
С2H4 + H2 = C2H6 (этан)
Еще одна «именная» реакция:
реакция Кольбе: электролиз солей карбоновых кислот :
2СH3COONa -(электролиз)-→ СH3-CH3 (этан) + 2СO2 +2Na
Реакция солей карбоновых кислот с аналогичными щелочами:
C2H 5 COONa + NaOH -- t° > C2H6 + Na 2 CO 3
Тест "Алканы"
1. У пропана и 3,3-диметилгексана общая формула:
CnH2n
СnH2n+2
СnH2n-2
СnH2n-4
2. Не имеет изомеров:
пентан
бутан
гексан
пропан
3. Выберите свойства алканов:
окисляются, реагируют с водой, обесцвечивают бромную воду
реагируют с галогенами, с галогеноводородами и с кислотами - окислителями
реагируют с хлором на свету, с азотной кислотой под давлением, крекинг
легко вступают в реакции замещения
4. При горении алканов образуются:
CO2 и H2O
алканы с меньшим количеством атомов углерода